恶性疟原虫青蒿素抗性的表观遗传机制研究
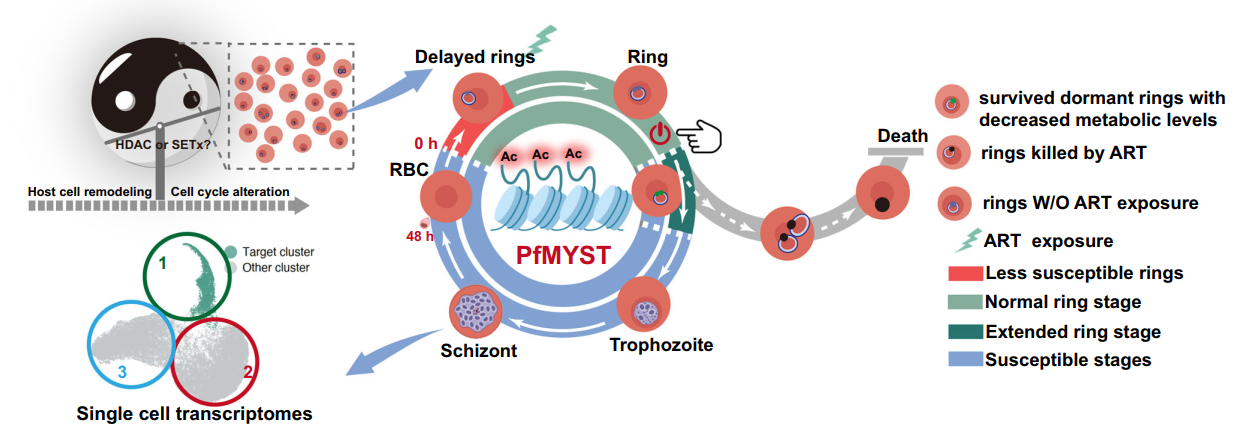
疟疾是严重威胁人类健康的重大传染病,药物治疗仍是当前疟疾防控的主要手段。青蒿素及其衍生物因其高效、低毒的特性,在全球抗疟治疗中得到广泛应用,其发现者屠呦呦先生也因此荣获2015年诺贝尔奖。但近年来疟原虫对青蒿素类药物逐渐产生抗性,青蒿素耐药性问题已成为全球疟疾防控的核心挑战。因此,深入阐明青蒿素耐药性产生的分子机制,不仅可为耐药性治理保护青蒿素类药物提供理论支撑,也是新型抗疟药物研发的重要参考。有研究发现,位于第13号染色体上的Kelch13(K13)基因与疟原虫青蒿素抗性密切相关,揭示了经典的遗传学调控途径在疟原虫青蒿素抗性机制中发挥了重要作用。本团队此前研究发现,在药物压力下,疟原虫可通过滞育机制延长早期环状体周期,缩短对青蒿素敏感的发育阶段,从而减弱药物对其的特异性杀伤效应,进而产生青蒿素耐受表型(iScience, 2022)。此外,结合境外输入性疟原虫样本库全基因组测序分析,发现大量非K13突变的虫株同样能够表现出青蒿素抗性,其分子机制有待阐明。
2025年7月23日,同济大学医学院张青锋/江苏省血吸虫病防治研究所曹俊课题组合作在Nature Communications(一区Top期刊,IF:15.7)上发表了题为“Epigenetically conferred ring-stage survival in Plasmodium falciparum against artemisinin treatment”的研究性论著,首次系统揭示了疟原虫青蒿素抗性产生的表观遗传学新机制。该研究聚焦疟原虫形成滞育状态的表观遗传机制,首次发现组蛋白乙酰转移酶PfMYST与疟原虫青蒿素抗性存在显著负相关性;并运用CRISPR-Cas9基因编辑技术,成功构建恶性疟原虫Pfmyst基因条件性敲减虫株,通过抗性表型及代谢表型的系统验证,证实当Pfmyst水平下降时,疟原虫可通过滞育产生抗性表型,且该表型能够随Pfmyst水平回升而可逆性改变。还进一步结合单细胞转录组测序技术,明确随Pfmyst水平下降而呈现滞育效应的虫体亚群,在单细胞层面深度揭示其通过调控早期环状体滞育状态介导青蒿素抗性的分子机制。
综上所述,该研究基于单细胞转录组测序等高通量分析技术,鉴定得到药物暴露后疟原虫滞育虫体亚群,并据此提出了一种基于表观遗传学的疟原虫青蒿素抗性新机制:当疟原虫遭遇青蒿素药物压力时,可通过表观遗传通路动态调整其生活史发育周期,使部分早期环状体期虫体进入滞育状态,缩短药物敏感阶段虫体的时长,从而产生耐药表型。这一发现为解析疟原虫耐药机制打开了全新视角,明确了疟原虫等病原生物通过表观遗传调控应对药物压力的新机制。

江苏省血吸虫病防治研究所副研究员俞心愉博士、同济大学生命科学与技术学院何金灿博士、同济大学医学院王常虹博士、美国国家过敏与传染病研究所穆箭兵博士、南昌医学院陈璇博士为本文共同第一作者;同济大学医学院张青锋教授、江苏省血吸虫病防治研究所曹俊研究员、同济大学生命科学与技术学院江赐忠教授、美国国家过敏与传染病研究所Thomas E. Wellems教授和法国斯特拉斯堡大学Didier Menard教授为本文共同通讯作者。原文链接:Epigenetically conferred ring-stage survival in Plasmodium falciparum against artemisinin treatment.
最近新闻
-
2025.12.24
-
2025.12.22
-
2025.12.12
-
2025.12.12
-
2025.12.12
-
2025.12.08
-
2025.12.08
-
2025.12.04
-
2025.12.02
-
2025.10.29









