卵形疟原虫疫苗候选抗原PocDBPII生物学特性分析
疟疾是疟原虫引起的蚊媒疾病,疟原虫在人体内的发育经过肝内期及红内期阶段,后者是疟原虫裂体增殖并引起临床症状的主要阶段,也是疟疾预防治疗的主要靶标。在感染人类的5种疟原虫中,卵形疟原虫的形态特征、临床综合征、复发特征等与间日疟原虫相似,使其在常规诊断中易被误认为间日疟,其流行率和危害被严重低估。间日疟红内期疫苗候选抗原DBPII在卵形疟原虫柯氏亚种(Plasmodium ovale curtisi)的同源物是入侵宿主红细胞过程中的重要配体。但关于PocDBP-RII (P. ovale curtisi Duffy binding protein domain region II)基本生物学特性的研究十分有限。
近日,江苏省血吸虫病防治研究所联合扬州大学在国际热带病领域知名期刊《Parasites & Vectors》上在线发表了题为“Elicitation of T-cell-derived IFN-γ-dependent immunity by highly conserved Plasmodium ovale curtisi Duffy binding protein domain region II (PocDBP RII)”的研究性论著。

该研究对93份来自17个非洲国家的输入性P. ovale curtisi样本进行分析。通过对样本的测序和中性测试研究了PocDBP-RII基因的遗传多态性和自然选择;利用qPCR研究了PocDBP-RII基因的拷贝数变异(copy number variation, CNV);并用CCK8试验测定了rPocDBP-RII免疫小鼠的淋巴细胞增殖情况,还采用蛋白芯片和流式细胞术分别用于评估免疫小鼠血清中抗rPocDBP-RII的抗体反应水平和脾脏中产生IFN-γ/IL-10的T细胞水平。
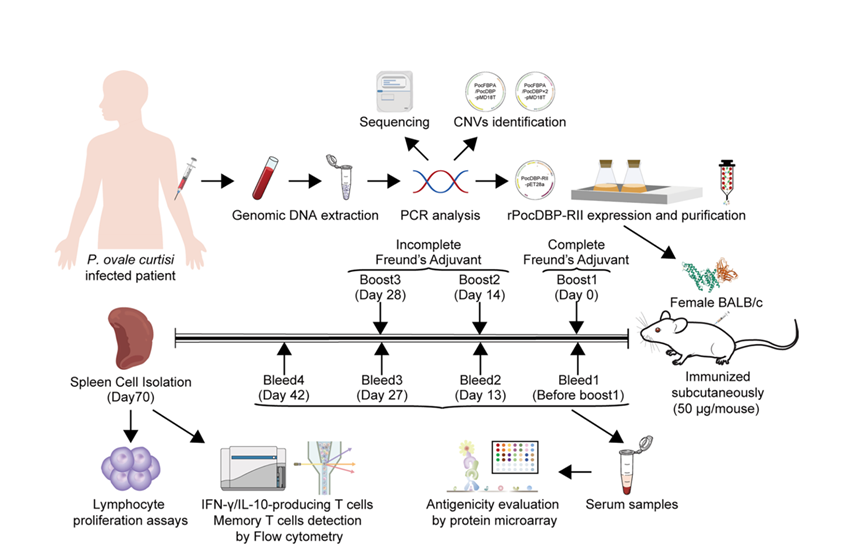
研究实验流程示意图
研究发现PocDBP-RII具有有限的遗传多样性和微弱的自然选择,所有分离株均携带单拷贝的PocDBP-RII基因。研究团队成功制备了可以被rPocDBP-RII免疫小鼠血清特异性识别的rPocDBP-RII蛋白,并通过蛋白芯片结果证实rPocDBP-RII抗原可以有效激发并维持小鼠的抗原特异性体液免疫反应。淋巴细胞增殖试验表明rPocDBP-RII蛋白在脾细胞中能诱导积极的增殖反应,胞内细胞因子染色分析表明rPocDBP-RII免疫能够诱导产生IFN-γ的T细胞,IL-10变化则不明显。此外,rPocDBP-RII刺激可以诱导抗原特异性记忆T细胞反应。总之,高度保守的rPocDBP-RII蛋白,能有效引发和维持小鼠的抗原特异性体液及细胞免疫反应,可以作为P. ovale curtisi红内期疫苗新型候选抗原。
扬州大学医学院陆凤教授和江苏省血吸虫病防治研究所曹俊研究员为本文共同通讯作者;扬州大学医学院任禛誉、江苏省血吸虫病防治研究所在读硕士施齐阳和常熟第二人民医院徐思敏为本文共同第一作者。
全文链接:https://parasitesandvectors.biomedcentral.com/counter/pdf/10.1186/s13071-023-05897-9.pdf
最近新闻
-
2026.01.20
-
2026.01.19
-
2025.12.24
-
2025.12.22
-
2025.12.12
-
2025.12.12
-
2025.12.12
-
2025.12.08
-
2025.12.08
-
2025.12.04









